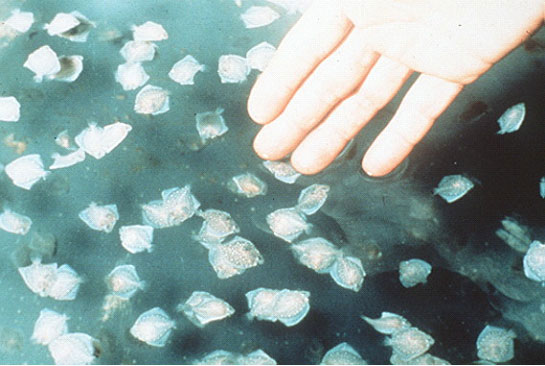
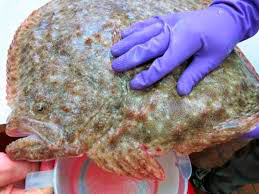
Технология искусственного разведения камбалы калкан разработана учёными для выращивания молоди черноморской камбалы-калкана. Способ направлен на повышение выживаемости личинок за счет создания максимально стерильных условий на всех этапах разведения вплоть до функционирования иммунной системы, а также обеспечения отбора наиболее жизнеспособных эмбрионов на этапе инкубации. 2 з.п. ф-лы, 1 ил.
Изобретение относится к рыбному хозяйству и может быть использовано на предприятиях для получения в искусственных условиях молоди черноморской камбалы-калкана.
Известен способ искусственного разведения черноморской камбалы-калкана который включает инкубацию пелагической икры, пересадку выклюнувшихся личинок в морскую воду, содержащую антибиотики и предварительно выращенные микроводоросли и коловратки, кормление личинок на 10-11 сутки жизни ежедневно науплиями артемии салина, удаление бактериальной пленки на поверхности воды на 5-8 сутки после выклева личинок и ежедневное внесение пенициллина и стрептомицина.
Однако, указанный способ не позволяет получать большое количество жизнестойких мальков, прошедших метаморфоз. Это связано с тем, что инкубирование икры проводится в непроточных емкостях и приводит к созданию неблагоприятных для икры газового и солевого режимов. Последовательное наращивание в выростных емкостях водорослей и кормовых организмов без достаточного водообмена приводит к резкому ухудшению характеристик воды в результате загрязнения остатками питательной среды для водорослей и метаболитами водорослей и кормовых организмов. Кроме того, обеззараживание водной среды с помощью антибиотиков ненадежно, т.к. приводит к появлению линий бактерий с повышенной резистентностью к конкретным антибиотикам.
Известен способ искусственного разведения черноморской камбалы-калкан включающий инкубацию пелагической икры и выдерживание личинок до 2-3 суточного возраста в циркулирующей и аэрируемой воде при температуре 14-16oC, выращивание личинок в интенсивных условиях при высоких плотностях посадки 30-50 экз/л с регулируемым температурным и световым режимами и пересадку личинок на 22-25 сутки жизни в вырастные установки из расчета плотности посадки 0,5-1,0 экз/л воды. При этом очистку воды и водообмен при выращивании личинок осуществляют путем использования биофильтра и замкнутой системы циркуляции воды, а обеззараживание за счет внесения антибиотиков. Культивирование живых кормов проводят отдельно и вносят в вырастные емкости за 7-8 дней до пересадки личинок, доводя плотности водорослей к моменту пересадки до (0,5-1,0)х106 кл/мл и коловраток до 30- 35экз/мл, а на 10-11 день жизни личинок ежедневно вносят науплий артемии в количестве 1-3 экз/мл.
Этот способ, являющийся по технической сущности наиболее близким к заявляемому, также не обеспечивает значительного увеличения выживаемости личинок рыб. К одной из причин низкой выживаемости личинок можно отнести щадящий режим инкубации икры (скорость водообмена 1-2 объема/сутки), при котором выживают и используются для выращивания эмбрионы, имеющие врожденные дефекты. В дальнейшем это приводит к высокой смертности личинок при переходе на внешнее питание. Кроме того, личинки камбалы очень чувствительны к бактериальному воздействию, т. к. до 30 суточного возраста у них отсутствуют иммунные тела и они почти беззащитны от воздействия как патогенной (главным образом Vibrio), так и большого количества непатогенной микрофлоры. Обеззараживание воды с помощью внесения антибиотиков не решает проблемы в связи с приспособляемостью бактерий к антибиотикам.

Наибольшая смертность личинок отмечена при их переходе на внешнее питание и в начале экзогенного питания. В это время погибают не только личинки, имеющие в своем развитии дефекты, препятствующие нормальному пищевому поведению, но также и значительная часть личинок, не имеющих явных морфологических и анатомических отклонений При этом наблюдается два последовательных пика смертности личинок, имеющих разные причины. Первый пик смертности (3-4 сутки после вылупления) отмеченный непосредственно перед переходом личинок на внешнее питание объясняется плохим качеством эмбрионов или стрессом при пересадке в выростные емкости, а также последствиями стресса в период инкубации. Погибающие в этот период личинки имеют различные дефекты в развитии. Второй пик смертности (6-8 сутки после вылупления) наблюдается в начале экзогенного питания и он совпадает с наступлением “точки необратимого голодания”, т. е. когда погибают не перешедшие на экзогенное питание личинки. Причиной этого пика смертности может быть не только ухудшение гидрохимических параметров среды в системах выращивания личинок при переводе их на питание, но и бактериальное загрязнение выростных бассейнов из-за внесения в них нестерильных кормовых организмов, а также гибель личинок, не перешедших на внешнее питание. Подавляющее большинство погибающих в этот период личинок не имеет видимых дефектов в развитии. Как правило, это личинки или с признаками атрофии желудка (не перешедшие на внешнее питание), или с пустыми желудками, но с остатками корма в кишечнике (прекратившие питаться). При этом нередко в желудках погибающих личинок находится большое количество бактерий.
Период жизни личинок калкана между 11 и 16 днем после вылупления также характеризуется повышенной смертностью, когда, как и в период второго пика, погибающие личинки с пустыми желудками не имеют дефектов в развитии. Причиной прекращения питания личинок и, как следствие, их гибели может быть бактериальное загрязнение бассейнов.
Данная технология направлена на повышение выживаемости личинок за счет создания максимально стерильных условий на всех этапах разведения вплоть до начала функционирования иммунной системы, а также за счет обеспечения отбора наиболее жизнеспособных эмбрионов в процессе инкубации.
Указанный технический результат достигается тем, что в способе искусственного разведения черноморской камбалы-калкан, включающем механическую очистку и обеззараживание воды, инкубацию пелагической икры и выращивание личинок в условиях водообмена с регулируемыми температурным и световым режимами, культивирование живых кормов и внесение в выростные емкости микроводорослей, коловраток и науплий артемии салины по потребности. Согласно изобретению, обеззараживание воды осуществляют после механической очистки до значения общего микробного числа равного нулю, на всех этапах разведения контролируют содержание микробных клеток и регулируют их численность, при этом инкубацию икры проводят со скоростью водообмена 7-14 об/сутки, обеспечивая содержание микробных клеток не более 500 на мл, и одновременно перемешивают икру воздухом с интенсивностью 0,01-0,03 дм3/мин, а выращивание личинок проводят с постепенным увеличением скорости водообмена от 0,3-0,5 об/сутки в начале выращивания до 4-5 об/сутки на начальных стадиях метаморфоза, поддерживая содержание микробных клеток не более 1-1,5 тыс.м.кл/мл.
Поставленная техническая задача решается также за счет того, что механическую очистку воды предпочтительно осуществлять пропусканием через песчано-ракушечный фильтр и систему микрофильтрации, обеспечивая размеры взвешенных в воде частиц не более 3 мкм, а обеззараживание проводить с помощью ультрафиолетового облучения. При возрастании содержания в воде микробных клеток в процессе выращивания личинок до 1-1,5 тыс. м.кл/мл целесообразно проводить регулярную полную смену воды и удаление микрофлоры со стенок выростных емкостей, а скорость водообмена увеличить до 24 об/сутки.
Живые корма целесообразно культивировать в накопительном режиме в обеззараженной воде и вносить в выростные емкости при содержании микробных клеток в культуре микроводорослей не более 50 м.кл/мл, в культуре коловраток не более 100 м.кл/мл, а в культуре науплий артемии не более 500 м.кл/мл.
Необходимость поддержания максимальной стерильности воды на всех этапах получения молоди камбалы-калкана обусловлена отсутствием у личинок иммунных средств защиты вплоть до стадии метаморфоза. Обеспечение требуемых стерильных условий с точки зрения бактериальной обсемененности обеспечивается за счет полного обеззараживания подаваемой в емкости воды после механической очистки до значения общего микробного числа равного нулю, контроля и регулирования содержания микробных клеток на всех стадиях разведения. Присутствие в подаваемой воде даже единичных микроорганизмов недопустимо, т.к. при попадании в благоприятные условия выростных емкостей (более высокая температура, наличие биогенных веществ) сразу же происходит резкое увеличение их численности. Требуемую степень обеззараживания воды можно обеспечить, в частности, с помощью ультрафиолетового облучения. Для эффективной работы бактерицидной лампы необходимо удалить взвешенные частицы размером свыше 3 мкм, т.к. взвесь, экранируя ультрафиолетовые лучи, препятствует полной стерилизации воды. С этой целью морскую воду, подаваемую в производственные емкости, целесообразно подвергать предварительной обработке, включающей механическую очистку через многослойный песчано-ракушечный фильтр, задерживающий крупные взвешенные частицы, а затем через систему микрофильтров, обеспечивающих задержку частиц крупнее 3 мкм.
Механическая очистка и обеззараживание воды до полного отсутствия микробных клеток могут быть осуществлены также другими известными методами.
Проведение инкубации икры калкана с высокой скоростью водообмена 7-14 об/сутки позволяет получить требуемые в микробиологическом отношении условия для развития полноценных эмбрионов. Содержание микробных клеток к концу инкубации не должно превышать 500 м.кл/мл, т.к. в период акклимации личинок к условиям выростных емкостей, (когда они сконцентрированы при высокой плотности в непроточных емкостях малого объема в течение нескольких часов) может произойти нерегулируемая вспышка численности микроорганизмов, что отрицательно скажется на выживании личинок при дальнейшем их выращивании. Граничные значения скорости протока во время инкубации обусловлены тем, что при скорости водообмена менее 7 об/сутки не обеспечивается поддержание минимальной концентрации микробных клеток, а при интенсивности водообмена выше 14 об/сутки возникает опасность травмирования полноценных эмбрионов.
Одновременное с интенсивным водообменом перемешивание икры воздухом со скоростью 0,01-0,03 дм3/мин создает достаточно жесткие условия, приводящие к гибели неполноценных эмбрионов, имеющих врожденные дефекты развития, что позволяет уже на этапе инкубации провести отбор наиболее жизнеспособных эмбрионов и снизить смертность личинок на первых этапах выращивания перед переходом на внешнее питание. Перемешивание икры воздухом во время инкубации с интенсивностью менее 0,01 дм3/мин не обеспечивает гибели неполноценных эмбрионов, а более 0,03 дм3/мин приводит к травмированию полноценных эмбрионов.
На этапе выращивания личинок содержание микробных клеток поддерживают не выше 1-1,5 тыс.кл/мл, т.к. это количество является критическим и дальнейшее их увеличение отрицательно сказывается на общей выживаемости.
Управление микробиологической ситуацией в выросных бассейнах достигается за счет увеличения скорости водообмена от 0,3-0,5 об/сутки в начале выращивания, когда бактериальная обсемененность невелика (до 500 м.кл/мл), а личинки в первые дни жизни еще слишком пассивны, чтобы противостоять большей скорости протока, до 4-5 об/сутки на начальных стадиях метаморфоза при увеличении количества микроорганизмов до их критического для личинок уровня. При этом в случае благоприятной микробиологической обстановки увеличение скорости протока выше 4-5 об/сутки нецелесообразно, т.к. приводит к вымыванию микроводорослей из выростных бассейнов, а менее 4-5 об/сутки ведет к увеличению скорости нарастания численности микроорганизмов и быстрому достижению ими критической для личинок концентрации.
Для поддержания благоприятной микробиологической обстановки в емкостях для выращивания личинок длительное время имеет значение микробиологическая частота вносимых в емкости живых кормов. При этом предельные значения содержания микроорганизмов для суспензии микроводорослей не более 50 м.кл/мл, для культуры коловраток не более 100 кл/мл, а для науплий артемии салина не более 500 м. кл/мл определены тем, что при внесении их в выростные бассейны вследствие разбавления микроорганизмов общее микробное число воды не увеличивается более, чем на 0,5 м.кл/мл, т.е. практически не изменяет количественное значение концентрации микроорганизмов и не влияет на микробиологическую обстановку в бассейне.
Получение урожая микроводорослей и коловраток с требуемой степенью чистоты достигается путем их культивирования в накопительном режиме с использованием полностью обеззараженной воды и питательной среды, в закрытых емкостях, при этом культивирование не следует проводить более 5-7 дней с целью снижения риска бактериального загрязнения. Обеспечение требуемой чистоты науплиев артемии салина достигается их выдерживанием в течение 40 минут в смеси растворов формалина (0,2%) и бихромата калия (0,1%).
Сохранению благоприятной микробиологической обстановки в процессе выращивания личинок способствуют также меры, принимаемые в случае достижения критического содержания микробных клеток 1-1,5 тыс. клеток/мл, что может произойти при внесении в емкости науплиев артемии, вследствие накопления продуктов метаболизма как кормовых организмов, так и личинок. Регулярная полная смена воды, удаление микрофлоры со стенок выростных емкостей и увеличение скорости водообмена до 24 объемов/сутки позволяет избавиться от излишнего количества микробных клеток. При этом более интенсивный водообмен экономически нецелесообразен, а скорость потока менее 24 об/сутки не обеспечивает поддержание предельно допустимого значения общего микробного числа при дальнейшем выращивании личинок.
Отличительные признаки заявляемого способа в своей совокупности приводят к достижению нового технического результата элиминации нежизнестойких эмбрионов уже на этапе инкубации и к обеспечению максимально стерильных условий на всех этапах разведения вплоть до стадии метаморфоза личинок и, тем самым, к повышению их выживаемости.
Морскую воду, используемую для инкубации икры, выращивания личинок и культивирования живых кормов, перед подачей в производственные емкости подвергают предварительной подготовке, которая включает механическую очистку, обеззараживание и термостатирование.
Механическую очистку осуществляют пропусканием воды через многослойный песчано-ракушечный фильтр, задерживающий крупные взвешенные частицы, а затем через систему микрофильтров, задерживающую механические частицы размером свыше 3 мкм. После механической очистки воду обеззараживают с помощью ультрафиолетового облучения с длиной волны 253-260 нм до полного уничтожения микробных клеток (общее микробное число равно нулю).
Оплодотворенную “мокрым” способом икру переносят в инкубационные аппараты с плотностью посадки 1-2 тыс.шт/л. Инкубацию проводят при скорости водообмена в инкубационных аппаратах 10 об/сутки и постепенным повышением температуры воды от 12-14oC до 15-16oC к концу инкубации.
Одновременно осуществляют активное перемешивание икры путем барботажа воздухом, увеличивая его от 0,01 дм3/мин на этапе морулы до 0,03 дм3/мин при переходе на этап гаструляции. При этом икра, имеющая дефекты в развитии, погибает и оседает на дно. Дважды в сутки подачу воды и воздуха останавливают и осевшую на дно погибшую икру удаляют сифоном. Одновременно контролируют содержание микробных клеток в воде. При достижении общего микробного числа 500 кл/мл увеличивают скорость протока воды до 14 об/сутки.
Длительность инкубации при указанных условиях составляет 5 суток. Количество выклюнувшихся личинок 60% от оплодотворенной икры. Повышенный отход икры объясняется элиминированием нежизнеспособных эмбрионов при жестких условиях инкубирования.
Выклюнувшихся личинок выдерживают в течение двух суток в аппаратах до момента, когда при остановке подачи воды и воздуха личинки собираются в плотный рой. Сконцентрировавшихся личинок стаканом переносят на несколько часов в емкости объемом 6 литров, которые помещены в выростных бассейнах, для акклимации личинок к условиям выращивания. Выход личинок после выдерживания составляет 95% от вылупившихся личинок или 55к% от оплодотворенной икры. При соблюдении указанных условий инкубирования общее микробное число в инкубационных аппаратах не превышает 500 микробных клеток/мл.
После акклимации личинки пересаживают в выростные емкости объемом 3 м3, заполненные обеззараженной водой, с плотностью посадки 30 экз/л и осуществляют проток воды со скоростью водообмена в начале выращивания 0,3-0,5 об/сутки, постепенно увеличивая по мере нарастания численности микроорганизмов до 4-5 об/сутки на начальных стадиях метаморфоза, поддерживая концентрацию микробных клеток не более 1-1,5 тыс.м.кл/мл.
В вырастные емкости за 5-6 суток до посадки личинок вносят микроводоросли Chlorella или Nanochloris до плотности 0,2-0,4)х106 клеток/мл, а через 2-3 суток коловраток из расчета 0,5 экз/мл. В процессе выращивания личинок в емкости дополнительно вносят микроводоросли для поддержания их плотности на первоначальном уровне и коловраток, поддерживая концентрацию 3-5 экз/мл, по достижении личинками возраста 9 суток ежедневно вносят науплии, а начиная с 13 суточного возраста метанауплии артемии салина, по поедаемости.
Микроводоросли и коловратки культивируют в отдельных закрытых емкостях в полностью обеззараженной воде в течение 6 дней. Перед внесением в емкости для выращивания личинок содержание микробных клеток в культуре микроводорослей составляло 40 м.кл/мл.
Для первоначального засева бассейнов микроводорослями до (0,2-0,4)х106 кл/мл и в дальнейшем для поддержания их плотности на этом уровне в бассейны объемом 3 м3 вносят не менее 30 литров суспензии микроводорослей при плотности их урожая (10-30)х106 кл/мл. Таким образом, при разбавлении культуры микроводорослей в 100 раз общее микробное число в воде для выращивания личинок увеличилось на 0,4 м.кл/мл.
Культура коловраток перед внесением в выростные емкости содержала 100 микробных клеток/мл. При внесении в бассейн емкостью 3 м3 15 л урожая коловраток происходит разбавление в 200 раз и общее микробное число увеличивается лишь на 0,5 м.кл./мл.
Науплиев артемии салина перед внесением в вырастные емкости обрабатывают в течение 40 минут в смеси 0,2% раствора формалина и 0,1% раствора бихромата калия. Перед внесением в емкости культура науплиев содержала 300 м.кл/мл. При внесении 3 л культуры науплиев в бассейны и разбавлении ее в 1000 раз количество микробных клеток в воде увеличилось на 0,3 м.кл/мл. Таким образом, внесение живых кормов практически не изменило микробиологическую обстановку в бассейне с выращиваемыми личинками.
Выращивание личинок проводят с постепенным увеличением температуры от 17-17,5oC до 20-21oC к 20-ти дневному возрасту и круглосуточном освещении 1-2 тыс. лк. Ежедневно контролируют содержание микроорганизмов. С момента внесения науплий артемии салина наблюдается увеличение скорости накопления микробных клеток, являющееся следствием накопления продуктов метаболизма как науплиев, так и личинок, служащих питательной средой для развития микроорганизмов.
До 20-ти суточного возраста личинок соблюдаемые условия микробиологической чистоты вносимых живых кормов, а также увеличение скорости водообмена до 5 об./сутки позволяет поддерживать общее микробное число до 1 тыс.м.кл. /мл. Однако к 21-м суткам количество микробных клеток достигло 1,5 тыс. что явилось следствием накопления продуктов метаболизма. Поскольку в используемых бассейнах водосливные устройства не позволяют полностью слить воду и очистить стенки бассейна от накопившейся микрофлоры, личинки пересаживают в бассейны объемом 0,2 и 1,5 м3. Отход личинок после пересадки составляет от 5 до 10% Дальнейшее выращивание проводят при следующих условиях: плотность посадки 2 тыс.шт/м3; освещение круглосуточное; температура воды – 20-22oC; кормление подрощенными науплиями артемии, водоснабжение – стерильной водой при скорости водообмена 24 объема/сутки. Кроме того, дважды в сутки воду в бассейнах спускают на 4/5 объема и удаляют микрофлору со стенок бассейнов. Выполнение перечисленных условий позволяет поддерживать общее микробное число в пределах 1 тыс. м.кл/мл.
В возрасте 25-30 суток личинки переходят от пелагического к донному образу жизни. В это время их переводят на питание искусственным кормом, давая его вместе с подрощенной артемией, постепенно сокращая количество и частоту внесения последней.
Перешедших на питание искусственным кормом личинок пересаживают в выростные бассейны площадью 1-6 м2 и кормят только искусственными кормами. В возрасте двух месяцев мальки достигают массы 2-2,5 г.
Соблюдение данной технологической схемы обеспечивает выживание личинок к 20 суткам до 60-80% а к двухмесячному возрасту до 40-50% от посаженных на выращивание личинок.