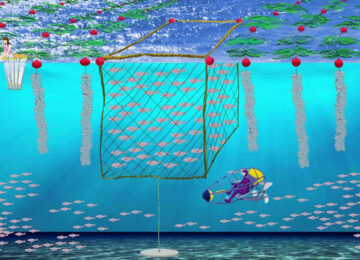
Отримання зрілих статевих продуктів у осетрових риб (Чстина 8)
Контроль за перебігом дозрівання самок та самців. Час дозрівання плідників залежить від температури води
Тривалість дозрівання самок осетрових риб при різних температурах:
1. Білуга: – 10-16ºС, термін созрівання – 78-30 год.
2. Російський осетер: – 12-16ºС, термін созрівання – 51-27 год.
3. Севрюга: – 14-22ºС, термін созрівання – 50-22 год.
4. Стерлядь: – 11-17ºС, термін созрівання – 52-26 год.
Якщо для самок застосовувалася одноразова ін’єкція GnRHa, розрахунки провадяться з урахуванням 5–6 годинної затримки дозрівання. Перегляд риб починають відповідно до розрахункового часу дозрівання перших самок.
Невеликих риб згинають у латеральному напрямку та оцінюють ступінь овуляції щодо виділення оваріальної рідини або ікри. Риб, що дають струмінь ікри, готують до операції зціджування (час від перегляду до зціджування ікри таких риб не повинно перевищувати 30-40 хвилин, наприклад, у севрюги це може призвести до повної резорбції всієї ікри).
Риб, що дають оваріальну рідину або окремі ікринки переглядають через 1 годину. Риб, що не показують ознак дозрівання, – переглядають через 2-3 години.
Перегляд зрілої самки з метою оцінки ступеня овуляції. У великих самок періодично пальпують черевце, і за рівнем його м’якості визначають найбільш зрілих з них. Для оцінки ступеня овуляції великих риб доцільно використовувати метод УЗД, застосування якого дозволяє уникнути можливих стресів. При цьому риба залишається у воді. Риб, що не показали ознак дозрівання після закінчення граничного часу дозрівання, бракують.
Для зниження стресування в ході огляду необхідно розділяти самок на групи за ступенем готовності до овуляції та розсаджувати їх по басейнам окремо. Для зниження втрат ікри від довільного вибою великих риб доцільно розміщувати по одній або дві особини на басейн. Взяття статевих продуктів у самців починають після того, як перші самки показали явні ознаки дозрівання – рясний струмінь оваріальної рідини з поодинокими икринками.
У разі виявлення самок, готових до негайного відбору ікри спочатку отримують ікру, а потім сперму. Прийоми переглядів плідників, в принципі, загальні для всіх видів осетрових, але конкретні особливості їх застосування залежать від виду, розмірів риб, типу рибоводних ємностей, у яких містяться самки після ін’єкції. Під час перегляду самок необхідно знизити до мінімуму стресуючі впливи (шум та різкі зміни освітленості).

Установка дрібних сит на зливних трубах з басейнів дозволяє вловлювати овульовані ікринки, оптимізуючи контроль за дозріванням самок. Для зниження стресової дії у темний час доби слід використовувати червоне світло з довжиною хвилі 680 нм, яке не сприймається осетровими.
Для полегшення роботи з самками при їх перегляді, перенос до місця відбору ікри та самому відборі необхідно мати спеціальне обладнання та матеріали (столи, ноші, рибоводні рукави тощо)
Відбір ікри, що овулювала. Нестача плідників, заготовлених у природних водоймах, тривалість та трудомісткість процесу формування маткових стад викликають необхідність прижиттєвого отримання ікри у самок осетрових риб. Існує кілька методів прижиттєвого відбору ікри.
Метод Подушки С.Б.В останні роки найбільш ефективним способом відбору овульованої ікри є метод надрізання яйцеводів з подальшим зціджуванням ікри, що є найменш травматичним для риб
При використанні цього методу самку поміщають на спеціальний похилий столик, що відповідає розміру риби, у положенні на спині головою вгору, щоб хвіст звисав. Через статевий отвір вводять скальпель, спрямований ріжучою поверхнею нагору (ширина леза має бути менше діаметра генітального отвору оперованої риби)і роблять надріз довжиною 1-2 см у каудальній частині стінки одного або обох яйцепроводів, відкриваючи цим невеликий отвір у черевній порожнині.

Через отриманий розріз ікру зціджують, акуратно масажуючи задню третину черевця.
Через годину після першого зціджування, при якому відбирають 80-90% ікри, проводять друге, а у великих і високо плодових риб іноді і третє зціджування. Після отримання ікри непотрібно зашивати та додатково обробляти розрізи.
У деяких випадках абдомінальні пори у самок можуть бути настільки великі, що без надрізу та додаткових зусиль через них може бути зціджена в один або два прийоми вся овулювала ікра. Інший ризик пов’язаний із можливістю випадкового пошкодження нирки або кровоносних судин у прямій кишці.
Зазвичай, подібні пошкодження не призводять до смерті риб. Недосвідчений оператор може пошкодити пряму кишку скальпелем. У цьому випадку ікра, що овулювала, виходить через анальний отвір. Як правило, ректальні рани, нанесені скальпелем, досить швидко гояться, у поодиноких випадках може статися зараження. Загалом, подібні пошкодження не є небезпечними для життя плідників. Мінімально інвазивний мікрохірургічний метод застосовується вже багато років.
Лапаротомія для більших риб (більше 130 кг) доцільно використати метод лапаротомії. Під загальною анестезією скальпелем виконується поздовжній розріз (довжиною 8-14 см, залежно від розмірів самки) у задній третині черевця,з відступом 15-20 см від середньої лінії. Через цей розріз потім відбираєтьсяовулювала ікра. Після відбору ікри розріз зашивають кетгутом, хірургічним шовком або капроновою ниткою. Зашивання розрізу є найбільш важким етапом оперативного методу, зважаючи на те, що тіло осетрових покритекістковими платівками
Область післяопераційної рани необхідно обробити антисептиком. Протягом наступних одного-двох тижнів за самками ведеться спостереження. Виживання самок при використанні лапаротомії 90% для білуги та 85% для російського осетр.
Метод багаторазового зціджування овулюваної ікри з яйцеводів невеликими порціями впротягом тривалого часу (6-12 годин), без операційного втручання. Як правило, за одне зціджування можна одержати до одного літра ікри. Недоліками даного методу є тривалість, трудомісткість, погіршення якості ікри до останніх порцій та неповне вилучення ікри. Цей метод не придатний для отримання ікри від великих промислових партій самок.
Анестезія виробників. При відборі статевих продуктів у великих риб масою понад 40 кг (білуга) доцільно застосовувати анестезію. У практиці осетрівництва використовуються анестетики:
1. Трікаінметансульфонат (MS-222) 40 мг/л (ванни). У м’якій слаболужної води (< 30 мг/л CaCO3) необхідно підвищувати рН додаванням NaHCO3. Наприклад, при використанні MS-222 у його розчин концентрацією 100 мг/л необхідно додавати 200-250 мг. бікарбонату натрію.
2. Гвоздична олія (евгенол 4-алліл-2-метоксифенол (C10H12O2))– 70–90%, ацетат евгенолу до 17% та каріофілен – від 5 до 12%. Концентрація гвоздикової олії 0,1 мл/л виявилася ефективною для анестезії різних видів та гібридів осетрових. У разі використання 5% розчину евгенолу (95% етилового спирту) – ванни при температурі води15ºС – 200 мг/л, при вищих, вище 20ºС – 100 мг/л.
Чутливість риб до дії гвоздикового масла залежить від температури води, при вищих температурах анестезія та процес відновлення настають швидше. Разом з тим, слід зазначити, що при використанні цього препарату, процес відновлення плідників довше в 5-6 разів, ніж при використання MS-222. Крім того, для зрошення зябер можна використовувати 0,1% спиртовий розчин емідату (Прописцин) або 5% розчин кетаміну який перед зрошенням зябер розлучається фізіологічним розчином у концентрації 1:3. Також можливе внутрішньовенне введення 5% розчину кетамін-гідрохлориду (кетамін-C13H16ClNO) 4-10 мг/кг маси риби. Анестезія досягається через 4-5 хв. і триває близько 10хв.
Отримання сперми та її зберігання у гіпотермічних умовах. Відбір сперми у великих риб (масою понад 7 кг) роблять за допомогою уретрального катетера з’єднаного зі шприцем Жане (150 мл), а у дрібних риб – шляхом згинання самців, спрямовуючи струмінь еякуляту у сухі чашки. У разі затримки використання відібраної сперми, короткочасне її зберігання здійснюють при температурі не вище температури води, у якій містилися самці.
Використання шприца Жане не вимагає переливання сперми в інші ємності, виключає потрапляння води та слизу та дозволяє відміряти необхідна кількість сперми без застосування додаткової мірної тари.
Шприц Жане та уретральні катетери. Стандартний набір включає 10 катетерів п’яти різних розмірів, що дозволяє підбирати катетер, що щільно входить у статевий отвір, неушкоджуючи його. Катетер та шприц повинні бути сухими та чистими. Самця фіксують на боці, черевом до краю столика, одночасно затискаючи статевий отвір і насухо витирають черевну частину, щоб запобігти потрапляння рідини до сперми. Катетер вводять в один із сім’япроводів на глибину 3-5 см і починають відбір сперми, спостерігаючи, щоб катетер не присмоктувався до стінок сім’япроводу, т.к. це може їх пошкодити та призвести до попадання крові у сперму. При відборі зразків сперми необхідно, насамперед, відбракувати еякуляти в яких видно згустки крові, жовч та інші забруднення.
У ряді випадків необхідно забезпечити гіпотермічне зберігання (1–2 діб і більше) відібраної заздалегідь сперми; при цьому сперма відбирається у сухі поліетиленові пакети або інші сухі ємності, що заповнюються сумішшю (кисень-повітря 1:1), або, що дещо гірше, чистим киснем, де оптимально зберігається при температурі 0-0,5ºЗ, але не вище 3ºС тонким шаром (не більше 0,5 см). Пакети можуть зберігатися в побутових холодильниках, у транспортних контейнерах (можна використовувати медичні сумки холодильники) для перевезення або у пінопластових ящиках з льодом (які у разі транспортування забезпечують підтримання температури не вище 4ºС), при цьому швидкість охолодження сперми не повинна перевищувати 15 (кращене більше 10º/год. Щодня замінюючи кисень, можна зберегти сперму осетра протягом 5 діб, з рухливістю 80% та виживання 99%.
Під час транспортування необхідно уникати різких поштовхів і сильної вібрації, оскільки збовтування сперми, що перевозиться неприпустимо.
Оцінка якості сперми. Для оцінки якості сперми осетрових риб використовують такі підходи:
– Рухливість сперматозоїдів за шкалою Персова: 5 балів – спостерігається поступальний рух усіх сперміїв, 4 бали – помітно поступальний рух більшості сперміїв, але в полі зору зустрічаються спермії з зигзагоподібним і коливальним рухом, 3 бали – зигзагоподібний та коливальний рух переважає над поступальним, є нерухомі спермії, 2 бали – поступальний рух відсутній, спостерігаєтьсятільки коливальне та зрідка зигзагоподібне, великий відсоток нерухомих сперміїв (до 75%), 1 бал – усі спермії нерухомі. Для дослідження рухливості сперміїв пробу розбавляють водою співвідношенні 1:20–1:50. Температура води має відповідатитемпературі еякуляту. Бракуються еякуляти, у яких активація сперміївспостерігається без додавання води, і в яких спермії злипаються до грудок.
– Концентрація сперміїв в одиниці об’єму еякуляту. Концентрація сперміїв в одиниці об’єму еякуляту (оцінюється візуально, млрд./мл):
– водяниста, кольори молочної сироватки – <1;
– рідка, кольори розведеного молока – 1–2;
– кольори незбираного молока, іноді з жовтуватим відтінком.
Еякуляти з концентрацією сперміїв менше 1 млрд./мл не рекомендується використовувати для запліднення і тим більше для гіпотермічного зберігання. Експериментально встановлено, що оптимальними співвідношеннями для запліднення однієї ікринки російського осетра є 500 000 рухливих сперміїв, севрюги – 300 000.
Час збереження активності сперматозоїдів у воді. У нормі час збереження активності сперматозоїдів у воді становить понад три хвилини. Концентрація сперматозоїдів може бути визначена також з використанням стандартного методу гемацитометрії. Термін збереження спермою запліднюючої здатності в умовах гіпотермічного зберігання в залежності від вихідної активності та часу збереження рухливості
Для точної та об’єктивної оцінки якості сперми використовуються сучасні методи потокової цитометрії, що дозволяють вимірювати швидкість та траєкторії руху сперміїв, концентрацію, кількість живих та мертвих клітин та інші характеристики з використанням комп’ютерних програм та відеомоніторингу. На жаль, у традиційній практиці осетроводства ці методи практично не використовуються, але при збереженні рідкісних та зникаючих видів осетрових та відборі самців при формуванні маткових стад, а також при кріоконсервації сперми їх застосування необхідне.
При зберіганні в одній ємності сперми від різних самців, запліднююча здатність такої суміші може різко знизитися і навіть бути повністю втрачена протягом 20-30 хв.


Оцінка якості ікри, що овулювала. Якість ікри та її придатність до запліднення визначається візуально, при цьому враховується однорідність забарвлення, правильна форма ікринок, відсутність резорбованих та активованих ікринок, прозора оваріальна рідина та ін. Крім того, як критерії оцінки ступеня дозрівання можна використовувати пружність ікринок та здатність їх приклеюватися до субстрату при попаданні у воду.
При нестачі ікри гарної якості таку (зрілу) ікру можна використовувати для відтворення, але інкубувати її слід за низької густини завантаження інкубаційних апаратів, а личинок підрощувати перші два тижні при меншій щільності посадки.
Штучне запліднення ікри. Техніка запліднення. Слід зазначити, що традиційно використовується на рибоводних заводах запліднення всієї ікри, отриманої від однієї самки сумішшю сперми від кількох самців, що не забезпечує належного рівня генетичної різноякісності одержуваного потомства, формування якої особливо важливо в умовах обмеженої кількості виробників та низької ефективної чисельності штучно формованої популяції.
Сперма різних самців має різну активність та концентрацію, значною мірою залежать від фізіологічного стану самців, умов їх переднерестового витримування та отримання сперми, кратності та часу відбору еякуляту.
У разі запліднення ікри від однієї самки спермою різної якості велика ймовірність переважання у потомстві особин від одного самця, що неприйнятно при формуванні гетерогенного стада чи популяції. Для отримання генетично-різноякісного потомства осетрових риб, ікру, отриману від однієї самки, доцільно розділяти на 3-5 порцій, осіменюючи кожну порцію спермою одного самця. Після запліднення ікру можна поєднати, знеклеюючи та інкубуючи разом. При різкому скороченні чисельності «диких» самок, використовуваних риборозвідними підприємствами, збільшення кількості самців, що використовуються при схрещуванні, дозволяє підвищити ефективну чисельність штучно формованих популяцій.
Осіменіння ікри осетрових проводять напівсухим «російським» способом. Даний метод дозволяє уникнути прояву поліспермії, обумовленої наявністю в яйцях осетрових риб великої кількості мікропилів
Необхідно проводити запліднення за годину після зціджування ікри.
Для короткочасного зберігання ікри (наприклад, у разі масового дозрівання самок і нестачі самців), її необхідно зберігати під шаром оваріальної рідини. Перед заплідненням необхідно по можливості обережно злити з ємності з ікрою оваріальну рідину, що перешкоджає запліднення ікри. Ікра осетрових швидко втрачає здатність до запліднення у разі контакту з повітрям та під впливом прямих сонячних променів, а також при високій температурі (вище за нерестову). Тому ікру перед заплідненням необхідно зберігати, а запліднення слід проводити в тіні. Ікру та сперму відбирають у сухі ємності. До ікри додають розчин сперми у воді в концентрації 1:200 (10 мл або дещо більше при невисокій якості сперми на 2 л води), що забезпечує найбільшу ймовірність моноспермного запліднення.
Це співвідношення може бути дещо змінено залежно від кількості в ікрі оваріальної рідини. Надлишок запліднюючого розчину при заплідненні «напівсухим» способом не може мати негативних наслідків, тому необхідно забезпечити співвідношення ікри та розчину, при якому забезпечується контакт всіх ікринок з запліднюючим розчином і всю суміш легко перемішувати. Після додавання запліднюючого розчину ікру інтенсивно перемішують протягом 2 хв. В останні роки також використовується «двотактне» запліднення. Після 50-60 сек. запліднення весь запліднюючий розчин з ємності зікрою виливається та заливається новий розчин зі спермою для завершення запліднення
У дослідницькій роботі (Billard et al., 1999) задля забезпечення синхронної активації всіх сперматозоїдів застосовували дворазове розведення сперми. Спочатку сперму розвели у співвідношенні 1:20 у розріджувачі з осмотичною концентрацією, близькою до значень сперміальної рідини, що не викликає активацію сперміїв, а потім в активуючому розчині в співвідношенні 1:30. У цьому випадку, при кінцевому розведенні 1:600 досягалася найкраща активація сперми.

Тривалість запліднення. Технологічно тривалість перебування ікри в запліднюючому розчині за діючими рекомендаціями визначається за такими параметрам:
• тривалість запліднюючої здатності сперми;
• час, протягом якого ікра здатна до запліднення;
• час до набуття ікрою клейкості.
Рекомендації, що діють визначають тривалість осіменіння для різних видів осетрових риб від 3 до 5 хв., забезпечуючи максимальну реалізацію запліднюючого потенціалу сперми, водночас практично вся повноцінна ікра, здатна до запліднення запліднюється протягом перших 30-60 секунд.
Знеклеювання ікри. Як знеклеювальну речовину традиційно застосовують мінеральний мул або тальк, проте найбільш ефективним знеклеювачем є “Блакитна” або вулканічна глина. Ефективним засобом є також танін, застосування якого вимагає точності дозування та часу обробки, оскільки перевищення цих параметрів може спричинити загибель ікри.
При знеклеюванні в ємність заливають суспензію глини, після чого суміш поміщають в апарат для знеклеювання, або обережно перемішують .рукою. Для забезпечення необхідного насичення суспензії киснем,через 15-20 хвилин після внесення мулу, додають порцію чистої води (20-25% обсягу). Тривалість знеклеювання залежить від виду осетрових.
Після знеклеювання ікру промивають водою до повного видалення знеклеювальної речовини. Вода, що використовується для промивання, повинна мати нормативні гідрохімічні показники (високий рівень вмісту кисню та ін.) і мати нерестову температуру.
(Дивись далі Частину 9)