Робота з плідниками осетрових риб (Частина 4)
Підготовку плідників осетрових риб до використання можна розділити на кілька етапів:
1 – осіння бонітування або відбір плідників осіннього ходу;
2 – зимівля плідників;
3 – весняне бонітування або відбір плідників весняного ходу;
4 – попереднє тестування плідників;
5 – забезпечення відповідних температурних режимів та термінів переднерестового утримування;
6 – тестування плідників перед ін’єкцією гормональних препаратів.
При міжсезонному отриманні зрілих статевих продуктів від плідників осетрових схема роботи виглядатиме інакше.
При роботі з пдідниками необхідно керуватися як візуально оцінюваними морфологічними ознаками, так і спеціальними методами оцінки функціонального стану репродуктивної системи самців та самок.
Більш важливі та актуальні в даний час принципи роботи з плідниками з вирощених маткових стад, які у найближчі роки мають стати основним джерелом отримання заплідненої ікри для Південно-Західної частини Чорного моря.
Основним завданням осіннього бонітування виробників є відбір риб, здатних дати зрілі статеві продукти в майбутньому рибному сезоні. Оскільки успішне завершення гаметогенезу залежить від багатьох факторів (умови зимівлі, температурні умови навесні, нагулі т.д.), деякі з риб, відібраних при осінньому бонітуванні, можуть бути відбраковані навесні (нажаль, в результаті різного роду зарегульованих адміністративних схем отримання дозволу на відлов осетрових плідників осіннього ходу та неможливості по технічних причинах утримання плідників взимку, відлов жодного разу на ДУ «Виробничо-експериментальний Дніпровський осетровий рибовідтворювальний завод ім. академіка С.Т. Артющика» не проводився).
Для вибору правильного режиму переднерестового утримання та отримання гамет, під час весняного бонітування проводиться відбір риб, чкі готові до нересту. При проведенні оцінки риба, яка не підходить для вирощування (відтворення) відбраковується

Цілі осіннього бонітування. Восени відбирають, для можливого використання у відтворенні, самок з гонадами, що перебувають у III, III-IV та IV стадії зрілості та самців з гонадами– у III-IV та IV стадії. Не слід резервувати для наступної нерестової компанії самців білуги, які брали участь у нересті цього року.
При осінньому бонітуванні бажано відокремити від основної групи або позначити такі групи самок:
– вперше дозрівають;
– з гонадами на ІІІ та ІІІ-ІV стадії зрілості;
– дуже зрілих та слабо вгодованих (після теплої зими), які будуть готові до нересту раніше за інших.
Осіння бонітування маточного стада та старшого ремонту проводиться при зниженні температури води до 12ºС, при якій рибу зазвичай припиняють годувати.
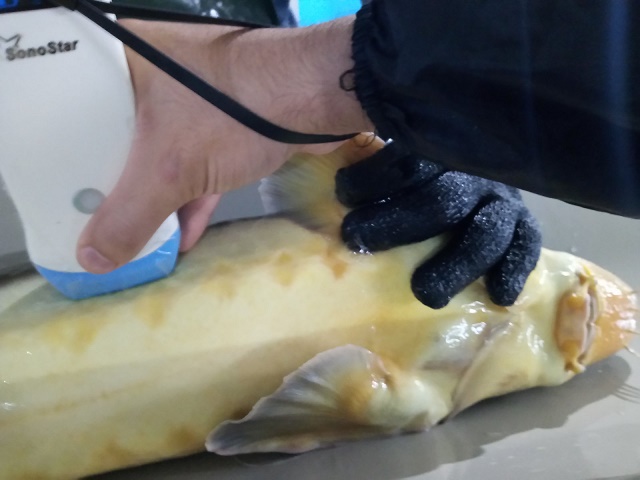
Для відбору зрілих плідників при осінньому бонітуванні оптимально використовувати метод визначення стадій зрілості гонад за допомогою не інвазивного експрес-методу УЗД За відсутності УЗД-сканера відбір проводять шляхом біопсійного, оперативного чи ендоскопічного вивчення гонад, що вимагає значно більшого часу та травмує рибу. Для проведення бонітування необхідно добре знати стадії розвитку гонад осетрових риб (наш осетровий завод не має апарату УЗД – як так? 21-ше століття!).
Стадії зрілості гонад осетрових риб. В даний час розроблено декілька класифікацій стадій зрілості гонад осетрових риб, що відрізняються різним ступенем деталізації, та навіть, числом стадій, що виділяються. Найбільш детальною є класифікація, у якій виділено як окремі стадії, так і підстадії гонадогенезу. Ця класифікація прийнята за основу при використанні ультразвукової діагностики статі та стадій зрілості осетрових риб.
Методи попереднього відбору плідників осетрових риб. Для осетрових риб характерна відсутність чітко вираженого статевого диморфізму. В даний час існує кілька різних методів визначення статі та стадій зрілості гонад незрілих осетрових, крім методу УЗД, включаючи:
– біопсійні методи;
– ендоскопія;
– ендокринологічний метод (аналіз вмісту статевихстероїдів);
– метод низькочастотного інфрачервоного сканування;морфометричні методи.
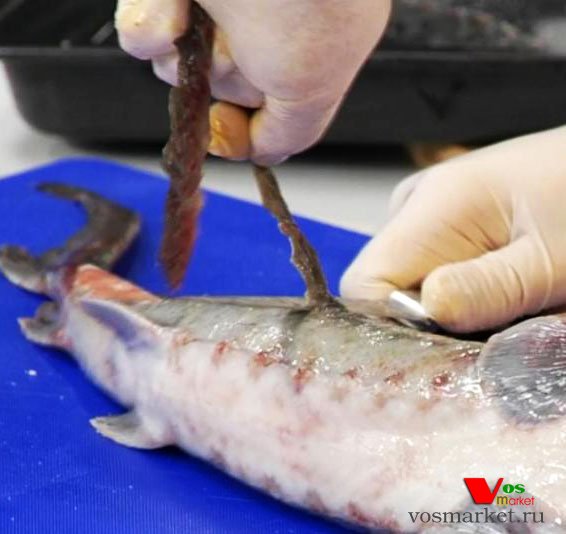
Біопсія гонад здійснюється шляхом введення через черевну стінку або через бічні м’язи спеціального сталевого щупа (діаметр для російської осетра – 4,5–5,0 мм, білуги – 5,5–6,0 мм, севрюги, стерляді 3–4 мм; довжина канавки – 3-6 см). Щоб уникнути пошкодження внутрішніх органів та полегшення відбору ділянки генеративної тканини, доцільно попередньо зробити прокол шкіри шилом, а потім відбирати пробу за допомогою щупу.
Попередньо продезинфікований щуп вводять між рядами бічних і черевних жучок у задній третині черевця риби під гострим кутом до осі тіла на глибину 5-7 см. При повороті щупа по осі, в канавці залишається тканинаг онади.
У США відбір зразків ікринок здійснюється за допомогою катетера (жорсткого, тефлонового, діаметром 4,5 мм) через невеликий (6-8 мм) абдомінальний розріз.
У гонадах риб у період нагулу частка жирової тканини значно більша ніж генеративної, у зв’язку з чим потрапити щупом у генеративну частину гонадне завжди вдається. Тому цей спосіб застосовний при тестуванні тільки зрілих самців і самок, починаючи з II-III та III стадій зрілості гонад.
При біопсії плідників осетрових риб, як попередній критерію відбору зрілих самок, рекомендується використовувати діаметр фолікулів. Наприклад, самки мають ооцити з діаметром не менше 2,6 мм (севрюга); 2,8 мм (сибірський осетр та шип); 3,2 мм (російський осетр) мають шанс дозріти за кілька місяців. Стадія зрілості остаточно уточнюється під час весняного бонітування.
Можна використовувати як критерій для відбору зрілих самок, мінімальну масу ооцитів у пробі (російський осетр – 16 мг, білуга – 22 мг, севрюга –11 мг, шип – 13 мг, стерлядь – 8 мг). У рибоводній практиці для того, щоб відрізнити жир від тканини насінника, біоптат поміщають у 4% формалін. Жир спливає, в той час, як тканина сім’яника тоне у формаліні, що дозволяє провести візуальне вивчення відібраної біопсійної проби.
Метод біопсії тривалий за часом і діє на риб негативно, стресуючи їх. Використання анестетиків при проведенні біопсії може призвести до загибелі риб (до 5%), внаслідок можливого їхнього інфікування.
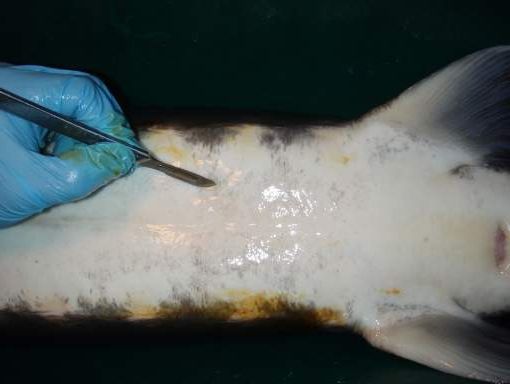
Пряма пальпація та лапароскопія Дослідження гонад може бути здійснене за допомогою пальпації. Визначення статі передбачає акуратне введення пальця у тіло риби через операційний отвір для вивчення структури гонад на дотик.
За допомогою методу прямої пальпації легко розрізнити гонади самок і самців, які досягли ваги 7-9 кг та віку 3–4 роки у разі російського осетра.
Досвідчений оператор може визначати підлогу у 300-500 риб на день. Насінник покритий тонкою оболонкою, гладкою на дотик. Яєчник не має оболонки, його поверхня нерівна, складчаста. Обмеження використання даного методу аналогічні обмеженням методу біопсії. Пряма пальпація гонад через операційний отвір є модифікацією оперативного методу Точність даного методу дещо вище, ніж біопсійного, проте він травматичніший і вимагає накладання операційних швів, а також триваліший за часом.
Ендоскопічні дослідження, що передбачають візуальне визначення статі та стадій зрілості, є більш сучасним способом вивчення гонад осетрових. Даний метод дозволяє візуально оцінити гонади за допомогою медичних діагностичних інструментів, таких як цисто уретроскоп або борескоп, що використовуються для дослідження захворювань урогенітальної системи.
Ендоскопічна система для визначення статі та стадій зрілості гонад здійснюється через оптико-волоконну систему приладу. Роздільна здатність методу досить висока, особливо для зрілих риб, оскільки через оптичну систему приладу добре видно найдрібніші деталі будови та фарбування тканин. При цьому, оскільки у зрілих риб зонд борескопа вводиться в порожнину тіла через статевий отвір, діаметр та довжина зонда повинні відповідати розмірам генітального отвору та насіннєвої протоки.
Для дослідження незрілих риб потрібно вводити зонд через невеликий (0,5-1,0 см) розріз у черевній порожнини, зроблений між другою та третьою жучками на лівому боці риби з боку хвоста.
Хороші результати дають борескопи з діаметром зонда 4 мм. Важливо при обстеженні обмежувати глибину введення зонда в порожнину тіла (шляхом використання гнучких зондів), щоб не пошкодити клапан воронки яйцеводу.
Оскільки довжина яйцеводів становить 14–16% від довжини тіла риби, використання борескопа з довжиною зонда 16 см, рекомендується для середніх по розміру риб, але для дуже великих риб слід використовувати зонди завдовжки 25 см.
Щоб уникнути травмування внутрішніх органів риб під час проведення ендоскопії, необхідно всі особини, навіть невеликі, повністю знерухомити за допомогою анестезуючих препаратів. Дослідження можна проводити в невеликих басейнах. У цьому випадку рибу перевертають на спину, залишаючи голову зануреною у воду, вводять зонд борескопа у статевий отвір і далі в правий або лівий яйцепровід паралельно поздовжньої осі тіла, коригуючи розташування зонда у тілі візуально через об’єктив. Гонади осетрових на І-ІІ стадіях розвитку візуалізуються як однорідна рожево-жовтогаряча тканина.
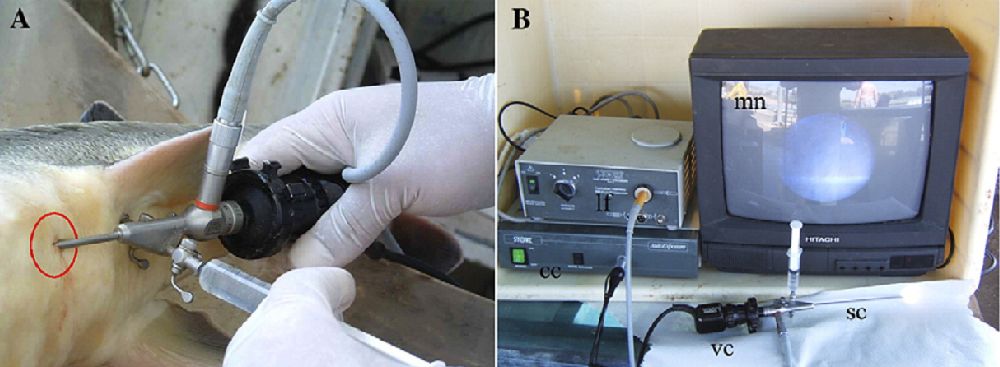
За допомогою ендоскопу стать російського осетра може бути визначена вже у віці трьох років (при цьому, кількість риб, у яких цим методом не вдалося визначити становило 5%). Точність визначення статі становила понад 98%. Разом з тим, при введенні ендоскопа через абдомінальний розріз 2% риб може травмуватис.
Період відновлення цих особин осетра складає два тижні. На відміну від біопсійних методів, ендоскопія має такі переваги:
– є мінімально-інвазивним методом;
– може бути проведена у польових умовах;
– тривалість дослідження становить кілька хвилин;
– дозволяє легко розділити риб на готових до нересту в поточному сезоні та незрілих;
– є легкою в освоєнні.
Слід зазначити, що цей метод має низку обмежень. Недоліком даної методики є те, що визначення статі проводиться на вигляд генеративної тканини, тому, часто неможливо розрізнити гонади самок і самців, що знаходяться на ранніх стадіях розвитку. Оптимальним є використання ендоскопії під час роботи зі зрілими самками для точного визначення стадій зрілості ікри та готовності до нересту.
Застосування методу ендоскопії для оцінки самців не доцільно. Перевагою всіх анатомічних методів є невисока вартість обладнання, що застосовується, а недоліком – їх травматичність.
Проникнення в порожнину тіла може не тільки негативно позначитися на фізіологічному стані риби, але і є сильним стресовим фактором. Крім того, операційні методи передбачають відстеження подальшого стану риби, загоєння операційних швів і лікувально-профілактичні заходи.
Ендокринологічний метод – це альтернативний, прижиттєвий, мінімально інвазивний метод, який полягає в оцінці концентрації таких статевих стероїдів, як тестостерон (T), 11-кетотестерон (11KT), естрадіолу (E2 або 17ß-естрадіол), у плазмі крові. Дана методика дозволяє достовірно розрізняти стать самців молоді севрюги (на основі відмінностей у концентрації T та E2 у плазмі) вже до моменту цитологічного диференціювання гонад самців у віці 10-12 місяців.
Концентрація тестостерону дозволяє здійснювати визначення статі різних стадіях зрілості. Ефективне та надійне використання цього методу вимагає, щоб моніторинг стану репродуктивної системи та вимірювання рівня T,11KT та E2 у самок та самців різного віку, проводився на осетрових господарствах різного типу (ставкових, тепловодних, з рециркуляцією).

Основним недоліком ендокринного методу є висока вартість проведення випробувань як у польових, так і в лабораторних умовах. Для проведення аналізів крові необхідно відповідне обладнання, певний тип системи мічення риб, додатковий робочий час для дворазового вилову риби (перший раз для мічення і вдруге для відокремлення самців від самок), а також час для проведення самих аналізів.
Метод МГК на основі змін концентрації плазми в стероїдних статевих гормонах та вмісту жиру. Згідно з отриманими результатами, метод Фур’є може бути корисним інструментом оцінки зрілості ооцитіву штучно вирощуваних осетрових і скоротить необхідність застосування інвазивного методу біопсії для визначення коефіцієнту поляризації (КП).
Таким чином, згідно з попередніми результатами, спектральний аналіз плазми за допомогою ФП-ІС може бути використаний замість біопсії та розрахунку індексу поляризації ооцитів.
Як зазначено вище, цей метод вимагає, щоб під час взяття зразків крові вся риба була помічена. Після отримання результатів аналізів, риба повинна бути повторно виловлена відділення самок і самців. Дана процедура вимагає великих трудових витрат і часто призводить до помилок під час мічення.
Морфометрія. Виявлено окремі морфометричні відмінності для показника Е в урогенітальній ділянці між самками та самцями бестера (Гібрид H. Huso x A. ruthenus) (у віці від 3 років). Очевидно, що точність визначення показника Е залежить від кута вимірювання, цього. За допомогою цього методу отримано коефіцієнти дискримінантного рівняння, що дозволяє досить легко визначити підлогу осетрових на основі краніологічних вимірів.
Виявлення окремих ознак статевого диморфізму у дорослих риб. Як і інших видів риб, для осетрових неодноразово робилися спроби встановити зовнішні статеві ознаки, але вдалося це, частково лише для дорослих особин. У практиці осетрівництва довгі роки використовували такі морфологічні критерії для відбору диких зрілих самок на осетрові заводи:
– самки, близькі до овуляції, мають тонку тішку (у менш зрілих риб вона більш товста та жирна);
– хвостове стебло від заднього краю спинного плавця до початку хвостового плавця має в поперечнику овальну форму, що вказує на схуднення риби;
– рило загострене за рахунок схуднення голови та всього тіла;
– жучки менш гострі, тому що у самок, близьких до овуляції, шкіра більше вкрита густим слизом;
– парні плавці у самок стерляді довші, ніж у самців;
– черевна частина самців російського осетра і білуги (H. huso) темніше, ніж у самок;
– жучки (вентральні та анальні) самок зрілого осетра стають м’якими, внаслідок мінералізації в період вітелогенезу.
Разомз тим, багаторічний досвід формування маточних стад різних видів осетрових риб показує, що найбільш ефективним методом є неінвазійна ультразвукова експрес-діагностика.

Документування результатів бонітування у кожній віковій групі риб визначають середню довжину та масу риб, оцінюють їх вгодованість та фізіологічний стан.
За підсумками бонітування риб поділяють на групи за статтю, стадіями зрілості гонад, при необхідності мітять груповими чи індивідуальними мітками і розміщують у зимувальних водоймах.
Риб відібраних для участі у майбутній нерестовій кампанії утримують у період зимівлі окремо. Протягом усього періоду бонітування ведуть робочий журнал, до якого записують таку інформацію:
– найменування виробничої ділянки;
– дата проведення операцій із рибою;
– вид та вік риби, з якою здійснюються операції;
– виробничі номери басейнів (водоймів, у яких міститьсядана риба);
– зміст операції;
– відомості про групове мічення риб.
За підсумками проведення бонітування складаються звітні документи: акти переміщення риб між виробничими ділянками, акти зариблення водойм (ставки, басейни, лотки), бонітувальні відомості.
Нажаль, на нашему Дніпровському осетровому заводі ніщо подібне не проводиться… Поки?…
(Дивись далі Частину 5)